|
191.- |
Interpretar de forma cualitativa la siguiente tabla:
|
Compuesto |
NaF |
NaCl |
NaBr |
NaI |
|
T. fusión (ºC) |
1000 |
800 |
750 |
670 |
y
predecir cuál de los dos compuestos NaF o CaO tendrá mayor temperatura de
fusión, teniendo en cuenta que tienen la misma estructura cristalina y sus iones
tienen radios similares. |
|
Solución |
|
|
192.- |
Cuatro elementos diferentes A, B, C y D, tienen de números atómicos 6, 9, 13
y 19 respectivamente. Averigua:
-
el número de electrones de la capa de valencia.
-
su clasificación en metales y no metales.
-
Las fórmulas de los compuestos que formará B con cada uno de los restantes
elementos y ordenarlos desde el más iónico hasta el más covalente.
|
|
Solución |
|
|
193.- |
¿Qué quiere decir que una molécula es polar? ¿Qué molécula será más polar el
CH4 o el NH3? ¿y entre el NH3 y el NF3? |
|
Solución |
|
|
194.- |
Dar una explicación entre los siguientes hechos:
-
el cloruro sódico tiene un punto de fusión de 800 ºC, en cambio, el cloro
es un gas a temperatura ambiente.
-
el diamante no conduce la corriente eléctrica mientras que el níquel si lo
hace. ¿Y el grafito?
-
el flúor es una molécula covalente mientras que el fluoruro de cesio es
iónico.
|
|
Solución |
|
|
195.- |
Indicar qué fuerzas atractivas han de ser vencidas para que se verifiquen
los siguientes procesos:
-
Disolución de nitrato sódico en agua;
-
Fusión de un cristal de hielo;
-
Ebullición de hidrógeno líquido y
-
Fusión de una aleación de plomo‑estaño (soldadura).
|
|
Solución |
|
|
196.- |
Justificar la geometría de las siguientes moléculas, así como su longitud de
enlace y su energía de enlace:
|
Molécula |
Ángulo de
enlace |
Longitud de
enlace |
Energía de
enlace |
|
C2H6 |
109'5° |
1'54 Aº |
346'94 KJ/mol |
|
C2H4 |
120° |
1'34 Aº |
610'28 KJ/mol |
|
C2H2 |
180° |
1'20 Aº |
836'02 KJ/mol |
|
|
Solución |
|
|
197.- |
Las
gráficas siguientes proporcionan los valores de temperaturas de ebullición de
algunos compuestos. Tratar de explicar las variaciones que presentan así como
las anomalías:
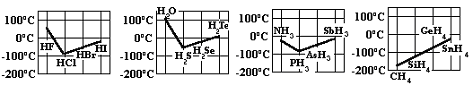 |
|
Solución |
|
|
198.- |
Teniendo en cuenta la estructura electrónica, ¿cuál es el motivo de que los
halógenos tengan predominantemente valencias impares? |
|
Solución |
|
|
199.- |
Indicar en qué sustancias de las mencionadas abajo existen enlaces por puente de
hidrógeno, para lo que es recomendable dibujar su estructura espacial:
|
Compuesto |
Mr (umas) |
T. Eb. |
Compuesto |
Mr
(umas) |
T.
Eb. |
|
CH4 |
16 |
- 161’4 |
CH3 - CH3 |
30 |
- 88’0 |
|
NH3 |
17 |
- 33’1 |
CH3 - NH2 |
31 |
- 6’7 |
|
H2O |
18 |
100,0 |
CH3 - OH |
32 |
65’0 |
|
|
Solución |
|
|
200.- |
Clasificar como covalente puro, covalente polar o iónico el enlace que
presentará la unión de los siguientes pares de elementos, explicándolo:
a) Li‑O b)
Br‑I c)
Mg‑H
d)
O‑O
e)
Rb‑F |
|
Solución |
|
|
201.- |
Escribir las estructuras de Lewis de los siguientes compuestos:
NF3 ; SO2 ; SF4
-
determinar su estructura espacial.
-
indicar para todas las moléculas si existen enlaces polarizados, en cuyo
caso, establecer qué átomo se cargará positivamente y cuál negativamente.
-
establecer cuáles de las moléculas son polares.
|
|
Solución |
|
|
202.- |
Clasificar como iónico, covalente molecular, covalente macromolecular o
metálico:
-
Un
sólido que funde por debajo de los 100 °C dando un líquido no conductor de la
electricidad.
-
Un
sólido que conduce la corriente eléctrica.
-
Un
sólido que no es conductor, pero sí lo es cuando funde.
-
Un
sólido aislante que no se disuelve en agua y funde a 2000°
-
Un sólido aislante que se disuelve en agua dando una disolución conductora de la
electricidad.
|
|
Solución |
|
|
203.- |
Escribir las estructuras de Lewis de los siguientes compuestos:
SiCl4 ; CO ; NO2‑
; BrF3
-
determinar su estructura espacial.
-
indicar para todas las moléculas si existen enlaces polarizados, en cuyo
caso, establecer qué átomo se cargará positivamente y cuál negativamente.
-
establecer cuáles de las moléculas son polares.
|
|
Solución |
|
|
204.- |
Escribir las estructuras de Lewis para el metano y el amoníaco. ¿Cuáles son
las fuerzas intermoleculares que mantienen unidas a sus moléculas en estado
sólido? ¿cuál de las dos sustancias tendrá un punto de fusión más elevado?.
Justifica las respuestas. |
|
Solución |
|
|
205.- |
Trata de identificar las siguientes temperaturas de ebullición a qué gas noble
Ne, Ar o Kr pertenecen. Justifica la respuesta.
‑152'30
°C, ‑246'05 °C, ‑185'71 °C |
|
Solución |
|
|
206.- |
Asigna correctamente a cada sustancia su punto de ebullición:
|
Compuesto |
CaO |
KF |
CsI |
|
Punto
de ebullición (°C) |
1280 |
1505 |
2850 |
|
|
Solución |
|
|
207.- |
Indicar el tipo de enlace interatómico e intermolecular de las siguientes
sustancias:
a) NaCl (s),
b)
NaCl (ac),
c)
NaCl (g)
d)
H2 (s),
e)
H2 (g)
f)
NH3 (g)
g)
NH4OH (ac) |
|
Solución |
|
|
208.- |
Explica el hecho de que el H2O, HF y NH3 tengan
puntos de ebullición superiores que el resto de los compuestos de hidrógeno
con los elementos de la misma familia. |
|
Solución |
|
|
209.- |
¿Por
qué los restantes elementos de la familia del oxígeno, nitrógeno o flúor no
forman también enlace de hidrógeno, si su configuración electrónica externa es
la misma que la de estos elementos?. |
|
Solución |
|
|
210.- |
Justificar, en base a la configuración electrónica del átomo central, la
existencia de estas moléculas: CO2 ,
PF3,
SO2 |
|
Solución |
|
|
211.- |
Las
neveras emplean para refrigerar gas freón, CF2Cl2,
un gas que ataca el ozono de la estratosfera. En las cámaras de gas se emplea
uno tóxico, HCN. Dibuja los diagramas de Lewis de sus moléculas. |
|
Solución |
|
|
212.- |
Explica el hecho de que siendo el fósforo y silicio elementos próximos en la
tabla periódica la molécula PF3 sea
polar mientras que SiF4 no
lo sea. |
|
Solución |
|
|
213.- |
Dada la tabla adjunta, ordena según su polaridad, los siguientes enlaces:
H--F, Cl--Cl, H--S, H--N, H--Cl, Cl--F, C--O, H--O, H--C
|
Elemento |
F |
O |
Cl |
N |
C |
S |
H |
|
Electronegatividad |
4,0 |
3,5 |
3,0 |
3,0 |
2,5 |
2,5 |
2,1 |
|
|
Solución |
|
|
214.- |
Explica la forma
geométrica de la molécula de H2O y justifica por qué el ángulo de
enlace es menor de 109º. |
|
Solución |
|
|
215.- |
Justifique la
polaridad o no polaridad de las moléculas de: CCl4 ,
SiH4 , BF3 ,BeI2 . |
|
Solución |
|
|
216.‑ |
Dados los
compuestos siguientes: NaCl, NaI, KCl, LiF, ordenarlos según un orden
creciente de distancia interiónica. |
|
Solución |
|
|
217.- |
Dados los
compuestos siguientes: OF2 ;
BF3 ; NF3,
dibuja sus diagramas de Lewis, pronostica su tipo de enlace, la polaridad de los
mismos y su geometría . |
|
Solución |
|
|
218.- |
Dibujar la
estructura de Lewis y describir la forma geométrica de las siguientes moléculas:
CO2, H2,
NH3, HCHO (metanal),
SO2. ¿Serán
moléculas polares?. |
|
Solución |
|
|
219.- |
Indica la
diferencia entre las propiedades físicas del cobre, del dióxido de carbono y
del fluoruro de cesio a partir del tipo de enlace de cada uno. |
|
Solución |
|
|
220.- |
Dados los elementos
A y B de números atómicos 9 y 19 respectivamente, indica: a) Tipo de enlace que
formarían: A-A, B-B y A-B. b) ¿Sería el compuesto A-B soluble en agua? ¿Por
qué?. |
|
Solución |
|
|
221.- |
Explica muy
brevemente por qué el agua disuelve a los compuestos iónicos mientras que el CCl4 no
lo hace. |
|
Solución |
|
|
222.- |
La molécula de
agua es polar, mientras que la de CO2 no
lo es. Explica estos hechos a partir de las geometrías moleculares. |
|
Solución |
|
|
223.- |
Representar según
Lewis la estructura del ión nitrato indicando también su geometría. |
|
Solución |
|
|
224.- |
Escriba la
configuración de Lewis de la molécula de metano, e indique geometría, ángulos
de enlace y si la molécula es polar. |
|
Solución |
|
|
225.- |
Indicar cuál es
el número de coordinación del ión sodio en el cloruro sódico. ¿Qué
estructura presenta el cloruro sódico?. |
|
Solución |
|
|
226.- |
El aspecto más
sobresaliente del enlace en los compuestos del carbono es que el carbono puede
formar cuatro enlaces con los átomos vecinos. Justifique este hecho. |
|
Solución |
|
|
227.- |
Dibujad las
estructura de Lewis y determinad la geometría molecular de las siguientes
moléculas: cloruro de hidrógeno, agua, trifluoruro de boro, acetileno, amoníaco,
tetracloruro de carbono. |
|
Solución |
|
|
228.- |
Dibujad las
estructuras de Lewis de las siguientes especies: ión óxido, bromuro de
hidrógeno, anión sulfato. |
|
Solución |
|
|
229.- |
Representad
la estructura de Lewis para las siguientes moléculas:
a) CF4,
b)
PCl5,
c)
PCl3,
d)
Br2.
¿Qué
geometría asignaríais a las moléculas CF4 y
PCl3?. |
|
Solución |
|
|
230.- |
Clasificad las
siguientes sustancias según su enlace sea iónico o covalente: agua, cloruro
sódico, acetileno, cloro, fluoruro de cesio, óxido de magnesio, óxido de calcio
y cloruro cálcico. |
|
Solución |
|
|
231.- |
Indicad la
geometría de las moléculas: BeH2,
BCl3 y CBr4. |
|
Solución |
|
|
232.- |
Clasificad las
siguientes especies químicas como sólidos, líquidos o gases a temperatura
ambiente: HCl, CH3COOH, CO2,
NH3, Cl2,
NaOH, I2, Fe,
CaCO3, KCl, NiCl2,
NaI, CH4. |
|
Solución |
|
|
233.- |
Dad ejemplos de
cinco elementos que sean gases, cinco que sean sólidos y uno que sea líquido a
temperatura ambiente. |
|
Solución |
|
|
234.- |
Indicad la
configuración electrónica del átomo de boro en su estado fundamental y
razonad cuál sería la geometría de la molécula BF3. |
|
Solución |
|
|
235.- |
¿Qué número máximo
de enlaces podrían formar los elementos C , B, As y Be con el flúor, si todos
los electrones de valencia de estos átomos participaran en la formación de
enlaces?. |
|
Solución |
|
|
236.- |
Clasificar
como covalente polar, apolar o iónico el enlace químico que se formará entre
los siguientes pares de elementos, explicándolo:
a) Li y O;
b)
Br y I;
c) O
y O;
d)
Rb y F. |
|
Solución |
|
|
237.- |
Escribir las
estructuras de Lewis para el CH4 y
el NH3. ¿Qué
tipos de fuerzas intermoleculares mantienen unidas a las moléculas de ambos
compuestos en estado sólido?. ¿Cuál de las dos sustancias tendrá punto de
fusión más elevado?. ¿Por qué?. |
|
Solución |
|
|
238.- |
Indicar el tipo de
enlace, interatómico e intermolecular, de las siguientes sustancias: NaCl(s);
C(diamante); H2 (s);
H2(g); NH3 (g). |
|
Solución |
|
|
239.- |
La metilamina, CH3NH2,
es el primer término de la serie de las aminas primarias. Representar esta
molécula mediante un diagrama de Lewis. Indicar el número de pares de electrones
enlazantes y no enlazantes. |
|
Solución |
|
|
240.- |
Ordenar y
justificar las siguientes sustancias según sus puntos de fusión crecientes:
NaCl, He, Br2,
Fe. |
|
Solución |
|
|
241.- |
Decir qué tipo de sustancia (iónica, molecular, etc.) es cada una de las
siguientes:
a) sulfuro de hidrógeno,
b) diamante, c) aluminio, y
d) nitrato potásico |
|
Solución |
|
|
242.- |
Ordenar los siguientes enlaces según su polaridad creciente, e indicar si
alguno de ellos es iónico:
a) Be--Cl,
b)
C--I,
c)
Ba--F,
d)
Al--Br,
e)
S--O,
f)
C--O.
teniendo en cuenta las electronegatividades:
|
Elemento |
Be |
C |
O |
F |
Al |
S |
Cl |
Br |
I |
Ba |
|
Electronegatividad |
1,5 |
2,5 |
3,5 |
4,0 |
1,5 |
2,5 |
3,0 |
2,8 |
2,5 |
0,9 |
|
|
Solución |
|
|
243.‑ |
Decir qué
tipo de atracción o de enlace químico ha de romperse para:
-
fundir cloruro
sódico,
-
sublimar
naftalina (naftaleno, C10
H8),
-
disolver bromo
en agua,
-
disolver bromo
en tetracloruro de carbono,
-
fundir oro,
-
vaporizar agua,
-
vaporizar C
(diamante)
|
|
Solución |
|
|
244.- |
Entre las
siguientes sustancias:
1) sodio, 2)
silicio, 3) metano, 4)
cloruro potásico y 5) agua,
escoger las
más representativas de:
-
Una sustancia
ligada por fuerzas de Van der Waals, que funde muy por debajo de la
temperatura ambiente.
-
Una sustancia de
alta conductividad eléctrica, que funde alrededor de los 200 ºC.
-
Un sólido
covalente de muy alto punto de fusión.
-
Una sustancia no
conductora que se transforma en conductora al fundir.
-
Una sustancia
con enlaces de hidrógeno.
|
|
Solución |
|
|
245.- |
Indicar el número
de pares de electrones enlazantes y no enlazantes en el entorno del átomo
central de la siguientes moléculas: H2O, PBr3,
BCl3, CO2.
Indica la geometría de las moléculas. |
|
Solución |
|
|
246.‑ |
Representar el
ión OH- mediante un
diagrama de puntos. Hacer un recuento de electrones para comprobar que tiene
una carga negativa. |
|
Solución |
|
|
247.- |
De los siguientes
compuestos: NCl5 y
PCl5, uno de
ellos no existe. ¿Cuál es y por qué?. |
|
Solución |
|
|
248.- |
Deducir la
geometría de la molécula de H2O, ángulo de enlace, naturaleza de los
enlaces que se forman, polaridad de la molécula y fuerzas intermoleculares que
puede presentar. |
|
Solución |
|
|
249.‑ |
Representar las
estructuras de Lewis de las siguientes moléculas, indicando la geometría
molecular y si es polar o apolar para las siguientes moleculas: SO2,
CS2 y HCN. |
|
Solución |
|
|
250.- |
Deducir la
geometría y la polaridad de las siguientes moléculas: HCN, AsCl3 y
SiH4. |
|
Solución |
|
|
251.- |
Clasificar cada uno de los sólidos siguientes según la naturaleza del
enlace:
-
amalgama de dentista (70% de Mercurio y 30% de Cobre);
-
bolas de naftalina (naftaleno, C10H8);
-
C (diamante);
-
cloruro de rubidio, RbCl.
Asignar a cada uno de ellos la propiedad siguiente que les cuadre más:
-
Muy duro.
-
Blando como la cera.
-
Punto de fusión por encima de los 2000 K.
-
Conductividad eléctrica elevada.
-
Maleable.
-
Con brillo metálico.
-
Cristal que se quiebra fácilmente al golpearlo.
-
Soluble en agua dando una disolución conductora.
-
Aislante que se convierte en conductor eléctrico al fundirse.
-
Con olor fácilmente detectable.
|
|
Solución |
|
|
252.‑ |
-
Escribid las
estructuras de Lewis del tricloruro de fósforo y el trifluoruro de boro.
-
Proponed una
estructura para cada uno de ellos.
-
Justificad el
diferente comportamiento polar de ambas especies.
|
|
Solución |
|
|
253.- |
Ordenar según la
polaridad creciente los enlaces de las siguientes moléculas: a) HI, HF, HBr, HCl;
b) CH4, BH3,
H2O, HF. |
|
Solución |
|
|
254.- |
Cuando reacciona
cloro (gas) con sodio (sólido) se forma cloruro de sodio (sólido). Estas tres
sustancias se caracterizan por poseer cada una un tipo de enlace diferente.
Explique brevemente las características del enlace en cada una de ellas. |
|
Solución |
|
|
255.‑ |
Concepto de
polaridad del enlace covalente. Explique cuál sería el orden de mayor a
menor polaridad de los enlaces N-N, N-F y N-O. |
|
Solución |
|
|
256.- |
Entre las
siguientes sustancias: i) Li, ii) diamante, iii) bromuro de cesio y iv)
agua:
-
¿Cuál de ellas
está formada por moléculas unidas por enlaces de hidrógeno?.
-
¿Cuál de ellas
es conductora?.
-
¿Cuál de ellas
presenta mayor punto de fusión?.
-
¿Cuál de ellas
es un aislante pero conduce la corriente eléctrica al disolverla en agua?.
Razone las
respuestas.
|
|
Solución |
|
|
257.- |
Dadas las
siguientes sustancias:
-
Bromuro de cesio;
-
Dióxido de nitrógeno;
-
Yoduro cálcico;
-
Sodio metálico.
Indicar el tipo de
enlace químico que predomina en cada una de ellas. |
|
Solución |
|
|
258.‑ |
Justifique la
geometría molecular de las siguientes especies: AsCl3,
CO2, H3O+,
BF3. |
|
Solución |
|
|
259.- |
El elemento de
número atómico 38 se combina con el elemento de número atómico 16.
-
Indicar la
configuración electrónica de los átomos de estos elementos en estado
fundamental y señalar a qué grupo de la tabla periódica pertenece cada uno
de ellos.
-
Indicar el tipo
de enlace y algunas propiedades del compuesto que resulta.
|
|
Solución |
|
|
260.- |
Dadas las
siguientes sustancias: H2, NaF,
H2O, C(diamante) y CaSO4:
Indique los tipos de enlace que presentan. y el estado de agregación, a 25 ºC y
presión atmosférica, que cabría esperar en cada caso. |
|
Solución |
|
|
261.‑ |
Dadas las
siguientes moléculas: diclorometano, tetracloruro de carbono, trifluoruro de
boro y amoniaco;
-
Justificar su
geometría molecualr.
-
Indicar que
moléculas presentan momento dipolar.
|
|
Solución |
|
|
262.- |
Represente las
estructura de Lewis, indicando geometría molecular y polaridad de las moléculas:
NH3, F2O,
SnBr2. Razone las
respuestas. |
|
Solución |
|
|
263.- |
Escriba las
estructuras electrónicas de Lewis de las siguientes especies: F-,
NH4+,
etano, eteno y etino. |
|
Solución |
|
|
264.‑ |
Sean X e Y
elementos del sistema periódico, de configuraciones electrónicas: 1s22s22p63s2
y 1s22s22p5, respectivamente.
-
¿Cuál será la
fórmula más probable del compuesto formado entre X e Y?.
-
¿Qué tipo de
enlace existirá entre X e Y?.
Razónelo. |
|
Solución |
|
|
265.- |
¿Cuál es la
configuración electrónica del ión Ca+2 y qué tipo de enlace presentan
el calcio elemental y el sulfato cálcico?. |
|
Solución |
|
|
266.- |
Dados las
siguientes sustancias: agua, hierro, cloruro potásico y amoniaco, indicar cual
es el tipo de enlace químico que presentan. |
|
Solución |
|
|
267.‑ |
Indicar si las
siguientes moléculas tendrán o no enlaces múltiples: HCN, CS2,
CO2 y BH3.
¿Cuál es su geometría?. |
|
Solución |
|
|
268.- |
Dados los
siguientes compuestos NO, H2S y K2SO4, se
pide razonar para cada uno de ellos:
-
¿En qué tipo de
compuesto lo clasificarías?
-
Estado de
agregación previsible a temperatura ordinaria.
|
|
Solución |
|
|
269.- |
A 272 K el
magnesio, el agua y el diamante son sólidos pero la naturaleza de sus retículos
es muy distinta. Explicar los tipos de sólidos que forman y deducir algunas
propiedades directamente relacionadas con su estructura. |
|
Solución |
|
|
270.‑ |
Dar una
explicación a los siguientes hechos:
-
El cloruro de
sodio tiene un punto de fusión de 800 ºC, en cambio el cloro es un gas a
temperatura ambiente.
-
El diamante no
conduce la corriente eléctrica, mientras que el níquel si lo hace, ¿y el
grafito?
-
El flúor es una
sustancia molecular, mientras que el fluoruro de cesio es iónico.
|
|
Solución |
|
|
271.- |
Clasifique
como: metálico, covalente, iónico o molecular.
-
Un sólido que
conduce la corriente eléctrica.
-
Un sólido que no
es conductor, pero sí lo es cuando se funde.
-
Un sólido
aislante que no se disuelve en agua y que funde a 2000ºC.
-
Un sólido
aislante que se disuelve en agua dando una disolución conductora de la
electricidad.
|
|
Solución |
|
|
272.- |
Naturaleza de las fuerzas de Van der Waals. Seguidamente se dan los siguientes
puntos de ebullición que corresponden a los gases nobles: Ne, Ar y Kr: : -152,3
ºC, - 246,048 ºC y -185,7 ºC. Diga a qué gas noble corresponde cada punto de
ebullición, explicando su respuesta. |
|
Solución |
|
|
273.‑ |
Diga qué tipo de sólido (molecular, covalente, iónico o metálico) forma cada
una de las siguientes sustancias, explicándolo: (i)
agua, (ii) silicio, (iii)
magnesio, (iv) sal común.
Para cada uno de ellos, determine las siguientes propiedades físicas:
-
punto de fusión (alto, medio, bajo);
-
conductividad eléctrica (conductor, aislante).
|
|
Solución |
|
|
274.- |
Dadas las siguientes sustancias: litio, etano, fluoruro de sodio y sílice
(dióxido de silicio), clasificarlas atendiendo al tipo de enlace que presenta:
-
Según su dureza.
-
La
que mejor conduce en estado sólido.
-
La
que presenta las fuerzas intermoleculares más débiles.
-
La
más soluble en disolventes polares.
|
|
Solución |
|
|
275.- |
Realiza un trabajo monográfico donde se reflejen:
-
tipo de enlaces
que mantienen unidos a los átomos o iones.
-
estructura de la
red cristalina.
-
justificación de
las propiedades físicas, químicas y mecánicas en base a los dos puntos
anteriores.
de
los siguientes compuestos:
-
cloruro sódico.
-
cloruro de
cesio.
-
Blenda (sulfuro
de cinc).
-
Cuarzo (dióxido
de silicio).
-
Carbono grafito.
-
Carbono
diamante.
-
Azufre en sus
distintas formas de cristalización.
|
|
Solución |
|
|