|
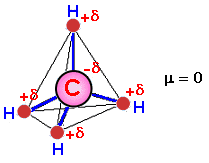
No debe confundirse un enlace polar con una molécula polar. Así, por ejemplo, el enlace C‑H es covalente polar, pero la molécula de metano (CH4) es apolar ya que dicha molécula tiene una estructura tetraédrica que, por su simetría, anula todos sus momentos dipolares.
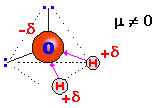
Para conocer si una molécula es polar o no hay que conocer su estructura espacial. El H2O es la molécula polar más característica. El ángulo que forman los dos enlaces O‑H es de 104'5º debido a la repulsión que ejercen sobre los electrones de los enlaces, dos pares de electrones que posee el oxígeno:
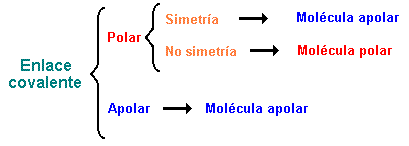
En definitiva, una molécula con enlaces covalentes apolares, será necesariamente apolar, pero una molécula con enlaces covalentes polares, será apolar si tiene simetría y polar si carece de ella, es decir:
Para ver la estructura espacial de las moléculas y conocer, en definitiva su polaridad, es muy cómodo utilizar las estructuras de Lewis. Aunque ya las hemos utilizado, vamos a profundizar un poco más en ellas. Para hallar la estructura de Lewis hay que tener en cuenta que:
Las estructuras de Lewis sirven tanto para representar átomos como iones o moléculas. Para ello hay que seguir los siguientes pasos:
por ejemplo, para el CO2:
siguiendo con el mismo ejemplo:
datos experimentales indican que el dióxido de carbono es una estructura resonante de las tres que hay representadas, teniendo mayor peso específico la del centro.
Veamos otro ejemplo representando la estructura de Lewis del ion nitrato (NO3‑):
datos experimentales demuestran que el ion nitrato es resonante siendo las tres estructuras equivalentes.
Como hemos indicado anteriormente, hay elementos que no cumplen la regla del octeto. Las causas pueden ser:
generalmente es el átomo central de la molécula el que deja de cumplir la regla del octeto. Vamos a verlo con algunos ejemplos:
1a) Monóxido de carbono (CO): el carbono actúa con índice de oxidación +2.
1b) Monóxido de nitrógeno (NO): Hay un número impar de electrones en la molécula, y el problema se resuelve con la resonancia, dejando el electrón impar en cada uno de los átomos de la molécula:
1c) Tricloruro de aluminio (AlCl3): En los casos en los que no se cumple la regla del octeto, la ecuación:
no se puede utilizar, ya que ella implica que cada uno de los átomos se rodea de ocho electrones. Luego, no podemos hacer uso de que en el tricloruro de aluminio hayan 4 enlaces, de hecho, se estructura de Lewis es:
2a) Pentacloruro de fósforo (PCl5):
como vemos, esta ecuación no se puede utilizar ya que en el compuesto al menos se necesitan 5 enlaces. Su estructura de Lewis se obtiene ampliando el octeto del fósforo, ya que, al pertenecer al 3er período tiene orbitales atómicos vacíos ("3d") donde se pueden albergar electrones:
no hay cargas formales ni resonancia.
2b) Dióxido de azufre (SO2):
si nos fiamos del resultado de esa ecuación, 3 enlaces, la estructura de Lewis sería:
serían dos estructuras resonantes con cargas formales, pero al poderse ampliar el octeto en el átomo de azufre, ya que pertenece al 3er periodo:
y datos experimentales demuestran la existencia de dobles enlaces. Siempre que sea posible eliminar cargas formales ampliando el octeto, se debe hacer.
2c) Ácido sulfúrico (H2SO4): Su estructura de Lewis sería:
para unir todos los átomos, pero, como el azufre pertenece al tercer período puede ampliar el octeto, y sabiendo que al tratarse de un ácido, los hidrógenos deben estar unidos directamente al oxígeno, se puede ver fácilmente que la estructura de Lewis del ácido sulfúrico será:
|