|
i) atendiendo al número de pares de electrones compartidos: a) enlace covalente simple: Cada átomo aporta un electrón al enlace, es decir, se comparte un par de electrones entre dos átomos. Un ejemplo es la molécula de Hidrógeno (H2):
Si los átomos están infinitamente separados, se considera que tienen
energía cero, pero a medida que se acercan existen fuerzas de
atracción
La molécula de Hidrógeno presenta una energía menor a la de los átomos separados (que es una condición indispensable para que exista enlace). En este caso los dos átomos de Hidrógeno adquieren configuración electrónica de gas noble. Otro ejemplo de este tipo de enlace sería la molécula de cloro:
los dos átomos de cloro tienen 8 electrones a su alrededor y por lo tanto configuración electrónica de gas noble. b) enlace covalente doble: Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos. Un ejemplo es la molécula de Oxígeno (O2):
c) enlace covalente triple: Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos, por ejemplo, la molécula de Nitrógeno (N2).
Es conveniente señalar que a medida que se compartan más pares de electrones, la distancia entre los átomos unidos será menor y el enlace será más fuerte (hará falta más energía para romperlo). Esto se puede comprobar con los datos de la siguiente tabla:
ii) atendiendo a cómo están compartidos los electrones:
b) enlace covalente polar: En un enlace covalente entre dos átomos iguales, los electrones del enlace se hallan igualmente compartidos, y el caso del enlace iónico constituye el otro extremo en el que los e‑ se transfieren totalmente.
Algunos ejemplos de este tipo de enlaces son: ‑ el cloruro de hidrógeno:
al ser el átomo de cloro más electronegativo, atraerá más hacia él los electrones del enlace y se quedará cargado con una fracción de carga negativa.
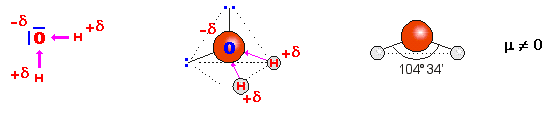
‑ el agua:
la diferencia de electronegatividad entre el O y el H explica su elevada polaridad y ésto hace que pueda utilizar como disolvente.
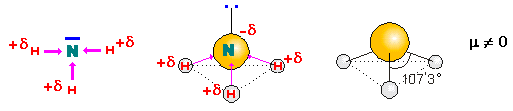
‑ el amoniaco:
la molécula de amoniaco posee tres enlaces simples polares.
c) enlace covalente coordinado o dativo: Es un enlace covalente en el que el par de e‑ que se comparte es aportado por un solo átomo. A los compuestos con este tipo de enlace se llaman complejos. Algunos compuestos con este tipo de enlace son: ‑ el ion amonio; por ejemplo en el cloruro amónico (NH4Cl): es un compuesto iónico, forma redes tridimensionales, (NH4+ Cl‑), donde el catión no es un átomo sino una especie poliatómica en la que sus átomos están unidos por enlaces covalentes, uno de ellos coordinado o dativo:
uno de los H ha perdido un e‑ y forma con el par de electrones que tiene el N, un enlace covalente coordinado.
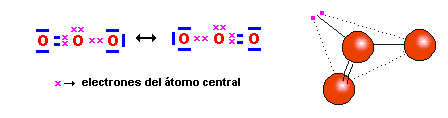
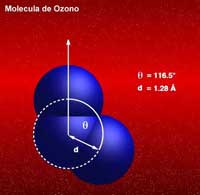
‑ el ozono: En el enlace simple, es el átomo central el que aporta los dos electrones del enlace:
aparecen dos estructuras para el Ozono que se denominan resonantes. El fenómeno de resonancia surge ante la imposibilidad de poder representar el estado electrónico de una molécula o ion mediante una sola estructura. En estos casos, ninguna de las dos (o más) estructuras resonantes tienen existencia real, sino una hibridación de todas ellas. Por ejemplo, en el caso del ozono, los dos enlaces que forma el átomo central con los de los extremos, son exactamente iguales a pesar de que, en la estructura de Lewis, uno de ellos sea un enlace covalente doble y el otro un enlace covalente coordinado. Este fenómeno de la resonancia es bastante frecuente.
|
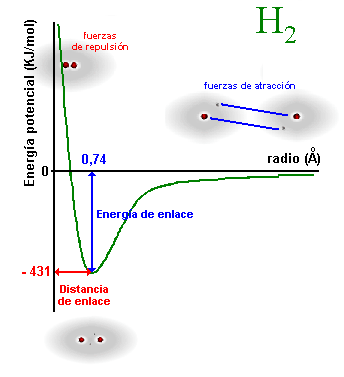 (entre
el e‑ de un átomo y el p+ del otro), y fuerzas
de repulsión, (entre las dos nubes electrónicas). Al principio las
fuerzas de atracción son superiores a las de repulsión por lo que al
acercarse se libera energía, pero llega un momento en el que las
repulsiones empiezan a tener importancia y cuesta cada vez más
acercarlos. Es decir, que la curva pasa por un mínimo y la distancia a
la que se produce es la distancia de enlace que para la molécula de H2
es de 0'74 Aº.
(entre
el e‑ de un átomo y el p+ del otro), y fuerzas
de repulsión, (entre las dos nubes electrónicas). Al principio las
fuerzas de atracción son superiores a las de repulsión por lo que al
acercarse se libera energía, pero llega un momento en el que las
repulsiones empiezan a tener importancia y cuesta cada vez más
acercarlos. Es decir, que la curva pasa por un mínimo y la distancia a
la que se produce es la distancia de enlace que para la molécula de H2
es de 0'74 Aº.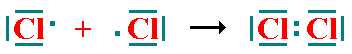
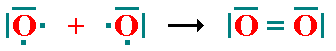
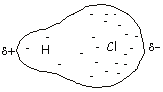 Cuando
dos átomos no son iguales, surgen situaciones intermedias en las que
los dos e‑ se encuentran compartidos
entre los dos átomos pero no por igual. Por ejemplo, en la
molécula de HCl el átomo de cloro es más electronegativo, lo que
indica que tiene mayor tendencia a atraer la nube electrónica hacia sí
que el hidrógeno, con lo que la molécula es eléctricamente asimétrica
con más carga negativa concentrada en el átomo de Cl y una cierta
carga positiva en el átomo de H; se crea un momento dipolar.
Cuando
dos átomos no son iguales, surgen situaciones intermedias en las que
los dos e‑ se encuentran compartidos
entre los dos átomos pero no por igual. Por ejemplo, en la
molécula de HCl el átomo de cloro es más electronegativo, lo que
indica que tiene mayor tendencia a atraer la nube electrónica hacia sí
que el hidrógeno, con lo que la molécula es eléctricamente asimétrica
con más carga negativa concentrada en el átomo de Cl y una cierta
carga positiva en el átomo de H; se crea un momento dipolar.