|
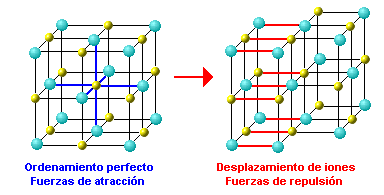
No contienen átomos sino iones y puesto que las fuerzas electrostáticas son muy fuertes, tendrán puntos de fusión y de ebullición muy altos. En estado sólido no conducen la electricidad, ya que los iones tienen posiciones fijas y carecen de movilidad, pero, al fundirse o disolverse en agua, se desmorona la red cristalina quedando los iones en libertad, por lo que estos compuestos fundidos o disueltos conducen la electricidad. Son sólidos muy duros porque las fuerzas electrostáticas que unen los iones son grandes, pero también son frágiles, ya que, al haber un ordenamiento tan perfecto en la red, pequeños desplazamientos de los iones hacen que las fuerzas que antes eran de atracción pasen a ser de repulsión, por lo que el sólido se rompe:
En general, los sólidos iónicos son solubles en disolventes polares y no en apolares, ya que, las moléculas del disolvente se colocan alrededor de los iones (orientando sus dipolos de forma adecuada), y éstos se separan de la red cristalina.
Hay que tener en cuenta que, no todas las sustancias que en disolución dan iones son sustancias iónicas; también lo hacen algunas sustancias covalentes polares como HCl o H2SO4. Podemos estudiar la variación de algunas de las propiedades que acabamos de comentar en base a las fuerzas electrostáticas y no direccionales que unen a los iones en la red cristalina. Dichas fuerzas vienen determinadas por la Ley de Coulomb:
por lo tanto, a medida que los iones estén más cargados, y sus radios sean más pequeños, las fuerzas electrostáticas que los unen serán más fuertes, por lo que, tendrán puntos de fusión y ebullición más altos, serán más duros, serán menos solubles, etc. Con los siguientes datos podrás apreciarlo con mayor facilidad:
|