|
En temas anteriores, ya hemos estudiado el átomo y ahora vamos a ver cómo se pueden combinar esos átomos entre sí. Este aspecto es muy importante ya que, como veremos, según el tipo de enlaces que formen, podremos predecir las propiedades de las sustancias. Las sustancias están constituidas por agrupaciones de átomos. Unas veces, tales agrupaciones forman agregados neutros: las moléculas y otras resultan con carga: los iones. Sólo los gases nobles y algunos metales en estado vapor están constituidos por moléculas monoatómicas (es decir, por átomos sueltos). La unión entre átomos, iones o moléculas es lo que constituye en enlace químico. En el enlace químico juega un papel decisivo la configuración electrónica de la capa más externa de los átomos, la de mayor energía, llamada capa de valencia. De esa configuración depende, además, el tipo de enlace que se formará, por ello, y dada su importancia, se utilizan los diagramas de Lewis, en los que figura el símbolo del elemento rodeado de tantos puntos como electrones de valencia posea. Así por ejemplo, los diagramas de Lewis de los elementos del segundo periodo son:
En la tabla periódica, todos los átomos de un mismo grupo tiene propiedades similares porque todos tienen los mismos electrones de valencia, y un átomo usa algunos o todos los electrones de valencia para combinarse con otros. Por otra parte, los gases nobles son muy estables ya que tienen una baja reactividad que se relaciona con su estructura electrónica; todos poseen los orbitales s y p de la última capa completos (a excepción del He). El hecho de que los orbitales de más alta energía de un átomo estén completamente llenos, les da una acusada estabilidad. Esto también se puede comprobar experimentalmente diciendo que tanto el P.I. como la A.E. de los gases nobles son muy altos, (no tienen tendencia ni a coger ni a ceder electrones). El resto de los átomos, tienden a ganar, perder o compartir electrones con la finalidad de adquirir configuración electrónica de gas noble y ganar así estabilidad. Por ello, los átomos se clasifican según esta tendencia en (además de los gases nobles antes descritos):
En general, se puede decir que cuando un átomo se combina con otro para formar un compuesto, lo hace de tal manera que con ello adquiere la configuración electrónica del gas noble más cercano, (ocho electrones en su última capa, regla del octeto) y eso se puede conseguir a través de una cesión, captación o compartición de e‑. Esta es la razón por la que los gases nobles son tan inertes. Hay elementos que no cumplen la regla del octeto, por ejemplo, el H, Li y Be, el número de electrones al que tienden es de dos puesto que el He, (gas noble más cercano), sólo tiene dos; y hay también muchos elementos del tercer período (o superior) que pueden albergar más de ocho electrones en su última capa al poseer orbitales "d" vacíos. Existen tres tipos fundamentales de enlaces: iónico, covalente y metálico, y con ellos se pueden formar cuatro tipos de sustancias: las iónicas, las moleculares, las covalentes y las metálicas.
Es
importante comentar que para que un determinado enlace se forme, tiene que
haber necesariamente un desprendimiento de energía, es decir, el compuesto
o molécula formada tiene que ser más estable que los átomos de los que se
parte, pues de lo contrario no se formará el enlace.
Cuando
dos átomos se encuentran infinitamente separados, no hay interacción entre
ellos, sin embargo, a medida que se acercan empiezan a aparecer fuerzas de
atracción entre el núcleo de uno y la nube electrónica de otro y viceversa
con la consiguiente liberación de energía. A una distancia determinada
(distancia de enlace), la energía liberada pasa por un mínimo (energía de
enlace). Si la distancia de enlace se hace más pequeña, empiezan a
aparecer fuerzas de repulsión entre los dos núcleos y las dos nubes
electrónicas, tanto más grandes cuanto más cerca estén, para lo cual haría
|
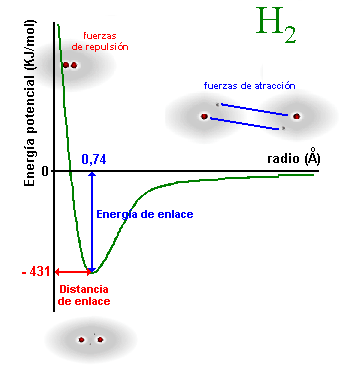
 falta
aportar energía, tal y como se muestra en la figura (los datos se refieren
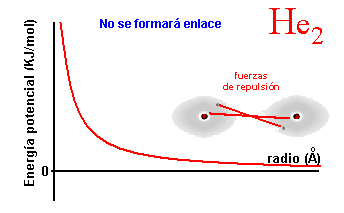
a la molécula de hidrógeno). Si los átomos nada más empezar a acercarse,
generan fuerzas de repulsión, tal y como muestra la segunda figura, nunca
formarán un enlace, porque no existe una distancia que estabilice el
sistema. Es lo que ocurre al acercar dos átomos de He, por ejemplo.
falta
aportar energía, tal y como se muestra en la figura (los datos se refieren
a la molécula de hidrógeno). Si los átomos nada más empezar a acercarse,
generan fuerzas de repulsión, tal y como muestra la segunda figura, nunca
formarán un enlace, porque no existe una distancia que estabilice el
sistema. Es lo que ocurre al acercar dos átomos de He, por ejemplo.